近日,我校医学院关新刚教授课题组在中科院一区TOP期刊《Nano Research》(影响因子:10.269)上发表题为“Engineering SIRPα cellular membrane-based nanovesicles for combination immunotherapy ”研究型论文,论文第一作者为联合培养硕士研究生王明月,关新刚教授为该论文第一通讯作者,红宝石官方网站hbs16为该论文的第一通讯单位。
癌症免疫疗法是通过激活机体自身免疫系统对抗癌症的新型治疗方法。近年来以PD-1及PD-L1抗体为代表的免疫检查点抑制剂(ICIs)成为全世界最受瞩目的癌症治疗药物。已获批上市的ICIs已被单独或联合用于临床十余种癌症治疗,实质性的改善了患者生存期。然而,现有ICIs的单药响应率低、免疫不良相关事件及肿瘤耐药等问题限制了其临床进一步应用。开发基于新靶点的高效ICIs药物成为当前抗肿瘤研究的热点前沿。
信号调节蛋白α (signal-regulatory protein α, SIRPα)是在巨噬细胞、树突细胞及中性粒细胞等髓系细胞上表达的吞噬信号检查点。正常细胞表面表达CD47 分子与巨噬细胞表面的SIRPα结合后释放 “don’t eat me”的信号, 从而保护其不受免疫系统攻击。肿瘤细胞通过表面高表达CD47配体分子并与与巨噬细胞上SIRPα受体结合,阻止巨噬细胞对肿瘤的吞噬,逃避免疫系统识别与攻击。目前已有CD47 抗体、SIRPα抗体、SIRP-Fc蛋白等多种吞噬检查点抑制剂已进入癌症临床 I/II 期试验。
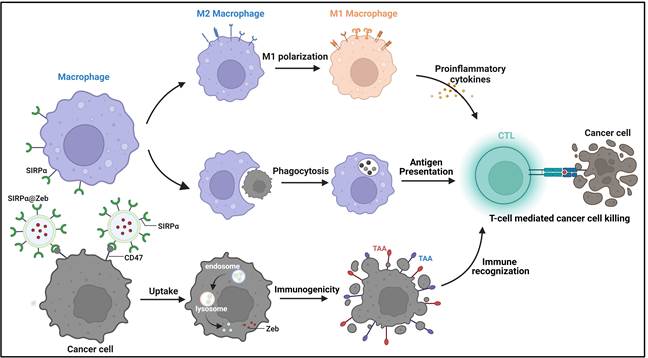
SIRPα细胞膜囊泡纳米药物多途径激活抗肿瘤免疫反应机理示意图
本研究设计制备了一种表达SIRPα受体的细胞膜纳米囊泡用于特异性地阻断CD47-SIRPα信号轴,促进巨噬细胞吞噬肿瘤,促进M2型巨噬细胞向M1极化,激活抗肿瘤免疫反应。另外,考虑到肿瘤通过低表达(或不表达)肿瘤相关抗原(tumor-associated antigen, TAA)逃避免疫监视,本研究利用SIRPα细胞膜囊泡内腔担载了一种DNA甲基化酶抑制剂泽布拉林(Zebularine, Zeb),通过Zeb增强黑色素瘤特异性抗原(CD146和TRP1)表达,促进免疫系统对肿瘤的识别;利用细胞膜囊泡上SIRPα受体与肿瘤细胞CD47配体结合,阻断肿瘤细胞与巨噬细胞间的“don’t eat me”信号,促进肿瘤抗原的加工递呈;通过极化的M1型巨噬细胞释放促炎因子,多途径激活机体抗肿瘤免疫应答,改善癌症治疗效果。本研究为基于吞噬检查点的ICIs药物研发提供了重要的数据支撑。
本研究由红宝石官方网站hbs16、中国科学院长春应用化学研究所和浙江大学合作完成,研究工作得到了红宝石官方网站hbs16、国家自然科学基金等课题资助。
论文链接:https://doi.org/10.1007/s12274-023-5397-4